Аутизм и нарушения развития
2012. Том 10. № 1. С. 17–28
ISSN: 1994-1617 / 2413-4317 (online)
Патология пищеварительной системы и аутизм
Общая информация
Ключевые слова: нарушения метаболизма, пищеварительная система, аутизм, психосоматика
Рубрика издания: Теория и методология
Тип материала: научная статья
Для цитаты: Мухина Ю.Г., Зоненко О.Г. Патология пищеварительной системы и аутизм // Аутизм и нарушения развития. 2012. Том 10. № 1. С. 17–28.
Полный текст
В настоящее время наметился потенциально важный и новый подход исследований в попытке понять причины возникновения аутизма как следствия нарушения метаболизма регуляторных пептидов.
Мозг содержит чрезвычайно большое число регуляторных нейропептидов, которые являются участниками синаптической передачи сигналов и дистантными регуляторами психосоматических функций. Значительная часть регуляторных белков нервной системы идентична белкам других органов, в частности, белкам органов пищеварения, в силу общности ряда базовых процессов жизнедеятельности. В связи с этим можно предполагать, что врожденные нарушения метаболизма нейропептидов могут одновременно проявляться и в нарушении метаболизма регуляторных пептидов, контролирующих те или иные функции желудочно-кишечного тракта. В результате при нарушениях психической деятельности возможно ожидать патологические процессы и в пищеварительной системе.
С другой стороны, существует обоснованное мнение, что расстройства психики возможны в результате первичной патологии в самом желудочнокишечном тракте. Идею того, что целостность барьера слизистой оболочки кишечника у людей с аутизмом нарушена, олицетворяет собой гипотеза «проницаемой пищеварительной трубки». Согласно этой гипотезе, слизистая кишечника чрезмерно проницаема при аутизме. Продукты переваривания пищи, такие как коровье молоко и хлеб, могут проникать сквозь проницаемый кишечный эпителий и вызывать иммунный ответ, а также влиять на работу ЦНС. Было установлено, что переваривание глютена и казеина в просвете тонкого кишечника под действием панкреатических и кишечных пептидаз высвобождает короткоцепочечные экзорфи- ны, которые структурно схожи с эндорфинами. Эти продукты назвали экзор- финами, для того чтобы подчеркнуть их пищевое происхождение (Zioudrou C., Streaty R.A, Klee W.A., 1979). Глиадомор- фины, относящиеся к семейству экзорфинов, высвобождаются из частично переваренного пшеничного белка глиа- дина. Аналогично, казоморфины (семейство экзорфинов) высвобождаются из частично переваренного молочного белка казеина (Chang K.J., Su Y.F., Brent D.A., Chang J.K., 1985). Казоморфины и глиадоморфины — мощные психоз-инду- цирующие факторы (Lindstrom L.H., Nyberg F., Terenius L., Bauer K., Besev G., Gunne L.M., Lyrenas S., Willdeck-Lund G., Lindberg B., 1984). Также это очень стабильные эпитопы.
Dohan (Dohan F.C., 1980) предположил, что при дефекте кишечного барьера нейроактивные пептиды пищевого происхождения могут поступать в кровь, а затем в цереброспинальную жидкость и оказывать прямое вмешательство в работу ЦНС. Способность экзорфинов проникать в ЦНС у млекопитающих была показана на крысах, у которых обнаружили меченые фрагменты глютена после перорального введения (Panksepp J., 1979). Более того, опиатные рецепторы головного мозга способны связываться с глютеновым экзорфином (Zioudrou C., Streaty R.A., Klee W.A.,1979). Введенный же в кровь крыс Ь-казоморфин-7 активировал прямой ранний ген (c-Fos) в нескольких отделах головного мозга крыс, что указывало на активацию мозговых клеток (Sun Z., Cade J.R., Fregly M.J., Privette R.M., 1999).
Масштабное гастроэнтерологическое обследование, проведенное в 2001 году на 500-х детях с синдромом аутизма, показало, что половина из них имеет разжиженный стул или частую диарею. Кроме того, была отмечена пищевая непереносимость пшеницы и коровьего молока (Lightdale J.R., Siegel B., Heyman M.B., 2001).
В двух других отдельных исследованиях (Lucarelli S., Frediani T., Zingoni A.M., Ferruzzi F., Giardini O., Quintieri F., Barbato M., D’Eufemia P., Cardi E., 1995; Knivsberg A., Reichelt K.L., Nodland N., Hoien T., 1995), включавших большое количество аутичных пациентов, было показано улучшение социальных, когнитивных, коммуникационных навыков в случаях, когда дети находились на без- глютено-молочной или же просто безмолочной диете.
Тест на кишечную проницаемость лактулозы у детей с аутизмом был значительно повышен, что отражает повреждение эпителиальных клеток (D’Eufemia P., Celli M., Finocchiaro R., Pacifico L., Viozzi L., Zaccagnini M., Cardi E., Giardini O., 1996). Эти данные позволили высказать мнение о том, что продукты неполного гидролиза глютена и казеина способны проникать через слизистый барьер. Дополнительный путь, по которому пищевые белки (глютен и казеин) могут проникать в подслизистую кишечника, — это микроскладки М клеток (Kerneis S., Bogdanova A., Kraehenbuhl J.-P., Pringault E., 1997). М клетки специализируются на транспорте антигенов и микроорганизмов из просвета кишки в субэпителиальное пространство. В субэпителиальном пространстве антигены и микроорганизмы взаимодействуют с клетками иммунной системы (Kerneis S., Bogdanova A., Kraehenbuhl J.-P., Pringault E., 1997).
Клетки лимфатических узлов реагируют на присутствие антигенов пищи выработкой антител, называемых иммуноглобулинами. Из пяти классов антител в пищеварительном тракте вырабатывается IgA. Любая молекула из полноценных пищевых белков или их производных (дериват) пептидов проникает через слизистый барьер посредством М клеток или между энтероцитами. Об их взаимодействии с иммунной системой свидетельствует факт значительного увеличения уровня IgA для пищевого казеина, глютена, лактальбумина, и b-лактоглобулина. IgG был повышен для казеина и глютена (Reichelt K.L., Ekrein J., Scott H., 1990; Lucarelli S., Frediani T., Zingoni A.M., Ferruzzi F., Giardini O., Quintieri F., Barbato M., D’Eufemia P., Cardi E., 1995); IgM был повышен для казеина. Исключение из диеты этих белков привело к снижению иммунной реакции. Этот ответ иммунной системы предоставил дополнительное подтверждение того, что кишечник аутичных детей излишне проницаем для глютена и казеина.

В более поздних публикациях (Wakefield A.J., Anthony A., Murch S.H., Thomson M., Montgomery S.M., Davies S., O’Leary J.J., Berelowitz M., Walker-Smith J.A., 2000) исследователи сообщили о своих наблюдениях, проведенных в группе детей из 60-ти человек с различными расстройствами психического развития, 50 из которых страдали аутизмом. 59 детей предъявляли жалобы на абдоминальную боль, запоры, диарею и рвоту. Результаты были сопоставлены с контрольной группой из 37-ми детей с аналогичными желудочно-кишечными жалобами. Проведенное параллельное эндоскопическое исследование выявило гиперплазию лимфатических узлов практически на всем протяжении ЖКТ у пациентов с аутизмом. Данный факт объяснялся тем, что клетки лимфатических узлов реагируют на присутствие антигенов пищи выработкой антител, иммуноглобулинов.
В литературе описаны немногочисленные работы, отрицающие связь аутизма с патологией пищеварительной системы (Black C., Kaye J.A., Jick H., 2002). Так, ученые из Великобритании не обнаружили связи между аутизмом и патологией кишечника на основании ретроспективной обработки медицинских карт. Они проанализировали карты 66-ти детей с диагностированным позднее аутизмом, и 30 карт детей, которым позднее был поставлен диагноз «возможный аутизм». Ученые не смогли выявить достоверные данные, свидетельствующие о наличии желудочно-кишечных воспалений, целиакии или пищевой непереносимости (Black C., Kaye J.A., Jick H., 2002).
Итак, в литературе существует довольно много исследований, свидетельствующих о возможной взаимосвязи желудочно-кишечных нарушений и проявлений аутизма, поэтому понятно стремление различных ученых исследовать эту проблему более глубоко и попытаться найти и объяснить механизмы описываемых фактов. Так, одним из таких возможных патогенетических факторов взаимодействия кишечной патологии и психических проявлений аутизма является регуляторный пептид секретин.
Секретин представляет собой полипептид, содержащий 27 аминокислот, каждая из которых активна (молекулярный вес около 3400). Он вырабатывается в так называемых S-клетках и присутствует в слизистой двенадцатиперстной и тощей кишки в неактивной форме просекретина. Когда кислый химус с рН менее чем 4,5-5 поступает в двенадцатиперстную кишку из желудка, это вызывает выделение дуоденальной слизи и активацию секретина, который затем абсорбируется в кровь. Единственно важной составляющей химуса, которая вызывает выброс секретина, является соляная кислота желудка.
Секретин, в свою очередь, вызывает секрецию больших количеств жидкости поджелудочной железой, содержащей высокую концентрацию бикарбонатного иона (вплоть до 145 mEq/L), но низкую концентрацию ионов хлора. Основная роль секретина заключается прежде всего в стимуляции щелочного содержимого протоками поджелудочной железы, в стимуляции желчи из протоков желчного пузыря, а также в ингибировании реабсорбции воды и солей в желчном пузыре, торможении секреции соляной кислоты и замедлении выхода химуса из желудка за счет торможения его мышечной активности.
Говоря о синдроме детского аутизма, следует остановиться на главных эффектах секретина — стимуляции секреции воды и бикарбонатов натрия поджелудочной железой и ингибировании секреции соляной кислоты желудком. Два этих эффекта помогают достижению нейтрального уровня рН в кишечном просвете. Каталитическая активность панкреатических пищеварительных ферментов оптимальна при показателях рН 7-8 и значительно снижается при повышенной кислотности среды (Johnson L.R., 1998). Высокая кислотность в просвете кишки способна повышать кишечную проницаемость путем изменения целостности достаточно плотной эпителиальной структуры, что доказано экспериментально. Так, выявлено, что при воздействии на слизистую кишечника крыс соляной кислотой в течение 30 минут, отмечаются серьезные повреждения на концах ворсинок и увеличение всасывания альбумина из кишки в кровь (Lundin P., Westrom B.R., Pantzar N., Karlsson B.W., 1997). Если гипосекреция секретина действительно имеет место при аутизме, то искусственно повышая его уровень в сыворотке у таких пациентов, можно добиться положительной динамики. Хорват и соавторы (Horvath K., Stefanatos G., Sokolski K.N., Wachtel R., Nabors L., Tildon J.T., 1998) докладывали, что внутривенное введение секретина в течение 5-ти недель пациентам с аутизмом действительно повысило уровень панкреатической секреции. В результате, у трех пациентов существенно снизились гастроэнтероло-
Патология пищеварительной системы и аутизм гические симптомы, и отмечалось улучшение в поведении, включая расширение словарного запаса. Эти неожиданные результаты вызвали значительный интерес.
Однако когда несколько ученых пытались повторить их результат на большом количестве пациентов, положительного эффекта от введения секретина не отмечалось ни при малых (Sandler A.D., Sutton K.A., DeWeese J., Girardi M.A., Sheppard V., Bodfish J.W., 1999; Chez M.G., Buchanan C.P., Bagan B.T., Hammer M.S., McCarthy K.S., Ovrutskaya I., Nowinski C.V., Cohen Z.S., 2000; Dunn-Geier J., Ho H.H., Auersperg E., Doyle D., Eaves L., Matsuba C., Orrbine E., Pham B., Whiting S., 2000; Lightdale J.R., Hayer C., Duer A., Lind-White C., Jenkins S., Siegel B., Elliot G.R., Heyman M.B., 2001), ни при больших дозах (Roberts W., Weaver L., Brian J., Bryson S., Emelianova S., Griffiths A., MacKinnon B., Yim C., Wolpin J, Koren G., 2001). В результате до сих пор роль секретина в коррекции больных аутизмом остается спорной. Суммируя приведенные исследования, можно сделать вывод, что большинство исследователей допускает наличие существования взаимосвязи между психическими проявлениями аутизма и желудочно-кишечными нарушениями. Возможно, патология в пищеварительной системе первично играет центральную роль в этиологии аутизма. В этом случае специально разработанная диета или патогенетическое лечение могут оказать лечебное воздействие на основное заболевание. С другой стороны, нельзя исключить, что желудочно-кишечные расстройства являются вторичными как результат врожденного нарушения метаболизма нейропептидов. Возможен и третий вариант, что патология желудочно-кишечного тракта является случайным спутником аутизма. Исходя из сказанного, можно сделать вывод о неизученности и необходимости исследования данного вопроса.
Именно поэтому крайне необходимо продолжать исследования состояния желудочно-кишечного тракта у детей, страдающих аутизмом.

МАТЕРИАЛЫ И МЕТОДЫ
Кафедрой Детских болезней № 2 РГМУ проводилось исследование гастроэнтерологического статуса детей, наблюдающихся в ЦПМССДиП. В исследование были включены дети от 3-х до 15-ти лет с диагнозом расстройства психологического развития.
Учитывая психические особенности детей, были выбраны щадящие, неинвазивные методы, но в то же время позволяющие достоверно оценить качество переваривания и всасывания отдельных компонентов пищи в пищеварительной трубке, функционирование органов желудочно-кишечного тракта и метаболизм кишечной микрофлоры. Программа обследования включала общий клинический осмотр, копрологическое исследование, липидограмму кала, анализ кала на углеводы, микробиологическое исследование кала, биохимическое исследование кала методом газово-жидкостной хроматографии, ультразвуковое исследование органов пищеварительного тракта. Полученные данные сравнивались с существующими нормами для детей соответствующего возраста.
Терапевтический осмотр прошли 95 пациентов, 46 детей прошли более углубленное обследование (в том числе УЗИ — 43 пациента, копрологическое обследование — 35 детей, липидограмму кала — 31, наличие содержания углеводов в кале — 31, микробиологическое исследование — 36, биохимическое исследование кала — 29 детей).

РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
1. Терапевтическому осмотру подверглись 95 детей. Ведущей гастроэнтерологической жалобой со стороны родителей пациентов были нарушения стула (70%), которые заключались как в проявлении запоров, так и диареи. На втором месте были жалобы на абдоминалгии (43 %). Важно отметить, что 20% родителей при сборе анамнеза отрицали наличие у своих детей нарушений в работе желудочно-кишечного тракта, хотя при дальнейшем обследовании эта патология была выявлена.
2. Ультразвуковое исследование органов гепатобилиарного тракта.
При проведении УЗИ органов брюшной полости (n=43) было выявлено увеличение размеров поджелудочной железы: головки в 30% наблюдений, тела в 15%, хвоста в 56% случаев, диффузное увеличение эхогенности поджелудочной железы отмечалось у 25% обследуемых. У половины детей отмечалось увеличение размеров печени. Изменения желчного пузыря отмечались у 18% детей (перегиб в средней трети, плотные стенки, неоднородное содержимое).

3. По результатам копрологического исследования неоформленный, кашицеобразный и жидкий стул был выявлен у 50% детей, наличие слизи у 89% аутистов, полупереваренные мышечные волокна обнаружены в 65% случаев, нейтральный жир у 65% детей, соли жирных кислот выявлены в кале 69% пациентов, перевариваемая растительная клетчатка обнаружена у 42% детей, наличие крахмала выявлено у 88%, и лейкоциты обнаружены у 83% исследуемых. Билирубин, соединительная ткань, эпителий и эритроциты отсутствовали у всех детей (см. табл. 1).
Таблица 1
Результаты копрологического исследования детей, наблюдающихся в ЦПМССДиП (n=35)
|
Форма |
Оформленная 35% |
Неоформленная 50% |
Плотная (овечий кал) 15% |
|
Цвет |
Коричневый 65% |
Светло-коричневый 16% |
Темно-коричневый 19% |
|
Запах |
Без особенностей 69% |
Резкий 31% |
Кислый - 0% |
|
Реакция |
Нейтральная 57% |
Слабокислая 39% |
Щелочная 4% |
|
Слизь |
Нет 11% |
Есть 89% |
— |
|
Стеркобилин |
Норма 88% |
Уменьшение 12% |
Увеличение 0% |
|
Остатки непереваренной пищи |
Нет 15% |
Есть 85% |
— |
|
Мышечные волокна |
Нет 35% |
Полупереваренные 65% |
Непереваренные 0% |
|
Жир нейтральный |
Нет 35% |
Небольшое количество 50% |
Большое количество 15% |
|
Жирные кислоты |
Нет 73% |
Небольшое количество 27% |
Большое количество 0% |
|
Соли жирных кислот |
Нет 31% |
Небольшое количество 46% |
Большое количество 23% |
|
Растительная клетчатка перевариваемая |
Нет 58% |
Есть 42% |
— |
|
Растительная клетчатка неперевариваемая |
Есть 27% |
Нет 73% |
— |
|
Крахмал |
Нет 12% |
Полупереваренный 69% |
Непереваренный 19% |
|
Иодофильная флора |
Нет 81% |
Есть 19% |
|
|
Кристаллы |
Фосфаты 19% |
Оксалаты 15% |
Шарко-Лейдена 3% |
|
Лейкоциты |
Нет 17% |
Небольшое количество 58% |
Большое количество 25% |
Полученные данные свидетельствуют о нарушениях переваривания и всасывания в верхних отделах пищеварительного тракта, гнилостной и бродильной диспепсиях, о нарушении метаболизма белков и липидов, нарушении моторно-эва- куаторной функции нижних отделов кишечника, воспалительных явлениях в толстом кишечнике.
4. При проведении липидограммы кала (см. диаграмму 1) было отмечено высокое содержание общих липидов у 81% исследуемых, при этом средний процент отклонения составил 69%. Наиболее часто было отмечено увеличение фосфолипидов — у 88% детей, процент отклонения 261,6%; моноглицеридов — 75%, холестенона у 68%, жирных кислот у 88% детей, средний процент отклонения — 152; триглицериды повышены у 56% аутистов, причем средний процент отклонения — 200. Показатель копростерола снижен в кале у 62% исследуемых детей.
Подобные изменения липидограммы кала могут свидетельствовать о патологии экзокринной функции поджелудочной железы, дискинезии желчевыводящих путей, а также о нарушении всасывания липидов в тонком кишечнике.
5. Содержание углеводов в кале детей с диагнозом расстройства психологического развития не выявлено, что соответствует норме (n=31).
6. По данным (n=36) микробиологического исследования содержимого толстой кишки были обнаружены выраженные количественные изменения в составе микрофлоры: стойкое снижение грампо- ложительной облигатно-анаэробной флоры. Количество бифидобактерий у 67% детей составляло 107-108, количество же лактобактерий у 52% аутичных детей составляло 104-106. Условно-патогенная флора определялась без изменений общей закономерности. Данные результатов микробиологического исследования
Диаграмма 1
Изменения показателей липидограммы кала у детей с аутизмом (n-31)
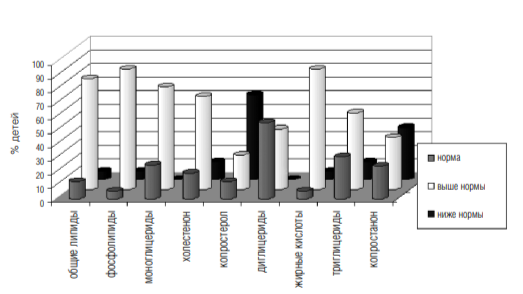
Диаграмма 2
Изменение состава ЛЖК в кишечнике микрофлоры кишечника показали только количественные изменения в составе нормальной микрофлоры.
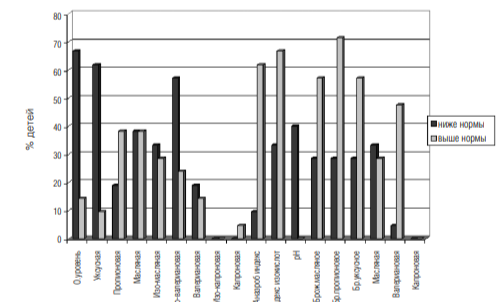
7. Для оценки функционального состояния микрофлоры и ее метаболической активности было проведено биохимическое исследование кала. По результатам исследования было выявлено значительное снижение общего уровня концентрации летучих жирных кислот (ЛЖК), в особенности уменьшение уксусной и изовалериановой кислот, кроме того, у 40% обследуемых детей отмечено снижение рН каловых масс (см. диаграмму 2). Также у преобладающего числа аутичных детей (62%) отмечено увеличение анаэробного индекса, индекса изокислот (67%) и повышение пропионового брожения, которое выявлено у 71% детей.
Данные изменения свидетельствуют о понижении метаболической активности нормальной микрофлоры, возможном снижении моторики толстой кишки, а также о дефиците пищевых субстратов. Кроме того, данные подтверждают факт угнетения популяций строго анаэробной микрофлоры.
ЗАКЛЮЧЕНИЕ
Полученные данные свидетельствуют о нарушении всех пищеварительных функций желудочно-кишечного тракта у обследуемых пациентов с диагнозом расстройства психологического развития, что соответствует литературным данным о заинтересованности пищеварительной системы у детей с аутизмом.
Выявленные нарушения касаются экзокринной функции поджелудочной железы, патологии всасывательной функции, дискинезий желчного пузыря, нарушения двигательной активности кишечника, нарушения метаболической активности микрофлоры толстого кишечника.
Эти объективно полученные факты дают основание для продолжения дальнейших углубленных исследований с целью определения причин, вызывающих выявленную патологию, и поиска возможной взаимосвязи гастроэнтерологической патологии и расстройств психологического развития.
Литература
- Zioudrou C., Streaty R.A., Klee W.A. Opioid peptides derived from food proteins. The exorphins. J Biol Chem 254:2446–2449, 1979.
- Chang K.J., Su Y.F., Brent D.A., Chang J.K. Isolation of a specific μ-opiate receptor peptide, morphiceptin, from an enzymatic digest of milk protein. J Biol Chem 260:9706–9712, 1985.
- Lindstrom L.H., Nyberg F., Terenius L., Bauer K., Besev G., Gunne L.M., Lyrenas S., Willdeck-Lund G., Lindberg B. CSF and plasma-casomorphin-like opioid peptides in post-partum psychosis. Am J Psych 41:1059–1066, 1984.
- Dohan F.C. Hypothesis: genes and neuroactive peptides from food as cause of schizophrenia. Adv Biochim Psychopharmacol 22:535–548, 1980.
- Panksepp J. A neurochemical theory of autism. Trends Neurosci 2:174–177, 1979.
- Sun Z., Cade J.R., Fregly M.J., Privette R.M. Casomorphin induces Fos-like immunoreactivity in discrete brain regions relevant to schizophrenia and autism. Autism 3:67–83, 1999.
- Lightdale J.R., Siegel B., Heyman M.B. Gastrointestinal symptoms in autistic children. Clin Perspect Gastroenterol 1:56–58, 2001.
- Lucarelli S., Frediani T., Zingoni A.M., Ferruzzi F., Giardini O., Quintieri F., Barbato M., D’Eufemia P., Cardi E. Food allergy and infantile autism. Panminerva Med 37:137–141, 1995.
- Knivsberg A., Reichelt K.L., Nodland N., Hoien T. Autistic syndromes and diet: a follow-up study. Scand J Educ Res 39:223–236, 1995.
- D’ Eufemia P., Celli M., Finocchiaro R., Pacifico L., Viozzi L., Zaccagnini M., Cardi E., Giardini O. Abnormal intestinal permeability in children with autism. Acta Paediat 85:1076–1079, 1996.
- Kerneis S., Bogdanova A., Kraehenbuhl J-P., Pringault E. Conversion of Peyer’s patch lymphocytes of human enterocytes into M cells that transport bacteria. Science 277:949–952, 1997.
- Reichelt K.L., Ekrein J., Scott H. Gluten, milk proteins and autism: dietary intervention effects on behavior and peptide secretion. J Appl Nutr 42:1–11, 1990.
- Wakefield A.J., Anthony A., Murch S.H., Thomson M., Montgomery S.M., Davies S., O’Leary J.J., Berelowitz M., Walker-Smith J.A. Enterocolitis in children with developmental disorders. Am J Gastroenterol 95:2285–2295, 2000.
- Black C., Kaye J.A., Jick H. Relation of childhood gastrointestinal disorders to autism: nested case-control study using data from the UK General Practice Research Database. Br Med J 325:419–421, 2002.
- Johnson L.R. Gastrointestinal physiology: Digestion and absorption. In: Johnson LR, Ed. Essential Medical Physiology, 2nd ed. Philadelphia, PA: Lippincott-Raven, 1998.
- Lundin P., Westrom B.R., Pantzar N., Karlsson B.W. Bidirectional small intestinal permeability changes to different-sized molecules after HCl-induced injury in the rat. Dig Dis Sci 42:677–683, 1997.
- Horvath K., Stefanatos G., Sokolski K.N., Wachtel R., Nabors L., Tildon J.T. Improved social and language skills after secretin administration in patients with autistic spectrum disorders. J Assoc Acad Minor Phys 9:9–15, 1998.
- Sandler A.D., Sutton K.A., DeWeese J., Girardi M.A., Sheppard V., Bodfish J.W. Lack of benefit of a single dose of synthetic human secretin in the treatment of autism and pervasive developmental disorder. N Engl J of Med 341:1801–1806, 1999.
- Chez M.G., Buchanan C.P., Bagan B.T., Hammer M.S., McCarthy K.S., Ovrutskaya I., Nowinski C.V., Cohen Z.S. Secretin and autism: a two-part clinical investigation. J Autism Dev Disorders 30:87–94, 2000.
- Dunn-Geier J., Ho H.H., Auersperg E., Doyle D., Eaves L., Matsuba C., Orrbine E., Pham B., Whiting S. Effects of secretin in children with autism: a randomized controlled trial. Dev Med Child Neurol 42:796–802, 2000.
- Lightdale J.R., Hayer C., Duer A., Lind-White C., Jenkins S., Siegel B., Elliot G.R., Heyman M.B. Effects of intravenous secretin on language and behavior of children with autism and gastrointestinal symptoms: a single-blinded, open-label pilot study. Pediatrics 108:E90, 2001.
- Roberts W., Weaver L., Brian J., Bryson S., Emelianova S., Griffiths A., MacKinnon B., Yim C., Wolpin J., Koren G. Repeated doses of porcine secretin in the treatment of autism: a randomized, placebo-controlled trial. Pediatrics 107:E71, 2001.
Информация об авторах
Метрики
Просмотров web
За все время: 1815
В прошлом месяце: 66
В текущем месяце: 44
Скачиваний PDF
За все время: 1309
В прошлом месяце: 9
В текущем месяце: 2
Всего
За все время: 3124
В прошлом месяце: 75
В текущем месяце: 46