Экспериментальная психология
2017. Том 10. № 3. С. 65–85
doi:10.17759/exppsy.2017100305
ISSN: 2072-7593 / 2311-7036 (online)
Оособенности вызванной активности мозга при анализе изображений эмоциогенного характера у носителей полиморфных вариантов генов BDNF и HTR2A
Аннотация
Общая информация
Ключевые слова: вызванная электрическая активность мозга, зрительные стимулы эмоциогеннного характера, ген BDNF, ген HTR2A, нейропластичность, серотонин
Рубрика издания: Психофизиология
Тип материала: научная статья
DOI: https://doi.org/10.17759/exppsy.2017100305
Для цитаты: Ермаков П.Н., Воробьева Е.В., Ковш Е.М., Столетний А.С. Оособенности вызванной активности мозга при анализе изображений эмоциогенного характера у носителей полиморфных вариантов генов BDNF и HTR2A // Экспериментальная психология. 2017. Том 10. № 3. С. 65–85. DOI: 10.17759/exppsy.2017100305
Полный текст
Введение
Человек традиционно рассматривается как сложный объект познания, в связи с чем методы изучения процессов, обеспечивающих его жизнедеятельность, а также специфику его реакций в ответ на стимулы окружающего мира, должны носить комплексный характер. Уровень развития современной науки позволяет нам достичь этого посредством применения междисциплинарного подхода к изучению природы указанных явлений.
Изучение генетических оснований психофизиологических особенностей — актуальное направление современных зарубежных исследований (Bilder et al., 2002; Bramon et al., 2006; Dumontheil et al., 2011). При этом в России данная проблематика только начинает свое развитие (Алфимова и др., 2011, 2014). Использование методов молекулярной генетики в нуждах психофизиологии оправдано существующей связью между отдельными группами генов (MAOA, COMT, 5HTR2A, BDNF, DRD2 и др.), системами нейромедиаторов (серотонина, дофамина, норадреналина, ГАМК и др.) и другими факторами, влияющими на деятельность нервной системы (в т.ч., нейротрофическим фактором мозга, поддерживающим развитие нейронов и синапсов) (Brady, 2015). Полиморфные локусы генов имеют вариативность строения, заключающуюся в возможности появления мутаций, что находит отражение в активности генов и особенностях действия факторов, ассоциированных с ними.
В нашей работе изучаются ген нейротрофического фактора мозга (BDNF) и ген рецептора серотонина HTR2A, каждый из которых имеет три формы — высоко-, низкоактивную и гетерозиготную, ассоциированные с различной чувствительностью рецепторов нейронов к пребыванию нейромедиаторов в синаптической щели (в случае гена 5HTR2A), а также — с уровнем выживания дофаминергических нейронов и питания — серотонинергических (в случае гена BDNF). На основании изложенного логично предположить, что данные гены ассоциированы с длительностью, интенсивностью и другими особенностями эмоциональных реакций, что, в свою очередь, может сказываться на специфике распознавания носителями разных генотипов отличающихся по параметру эмоциональной валентности стимулов (например, несущих угрозу и нейтральных) и отражаться в параметрах вызванной активности мозга. Таким образом, на возможную связь полиморфных вариантов генов BDNF и HTR2A с индивидуальными особенностями зрительного восприятия указывает роль этих генов в нейрохимическом метаболизме (влияние на концентрацию нейромедиаторов, состав белков и синаптическую пластичность).
Нейротрофический фактор мозга, brain-derived neurotrophic factor (BDNF) является наиболее распространенным нейротрофином в головном мозге, стимулирует дифференциацию нейронов и синаптическую нейропластичность, а также выживаемость нейронов в зрелом возрасте (Chen et al., 2004; Pearson-Fuhrhop et al., 2009). Нейротрофины представляют собой семейство факторов роста в головном мозге, которые играют ключевую роль в нейронной пластичности. Ген BDNF расположен на коротком плече хромосомы 11 и содержит однонуклеотидный полиморфизм (SNP) Va^Met,^ котором возможна замена гуанина на аденин (G196A). Такая замена сопряжена с замещением аминокислоты валин на метионин в кодоне 66, а аллели данного гена имеют название Val и Met. При этом аллель М^^ препятствует внутриклеточному трафику BDNF, уменьшая секрецию-нейротрофического фактора мозга, что связано с переходом от пластичности к статичности (стабильности) в нейронных сетях (Egan et al., 2003). Аллель Met оказывает влияние на транспорт нейропептида внутри клетки и снижает зависимую от деполяризации секрецию BDNF (Алфимова и др., 2009).
Известно, что распространенность аллелей Val66Met варьирует у разных этнических групп. Так, в работе Shimizu et al., 2004 было получено, что частота встречаемости аллеля Met составляет около 30% среди населения Соединенных Штатов и около 66% населения Японии (Shimizu и др., 2004). Подтверждение этому было получено и в работе Barton et al., 2014, в которой также установлено, что генотип Val/Met примерно в два раза чаще встречается у азиатских популяций по сравнению с кавказскими популяциями. В среднем частота встречаемости генотипа Met/Met невысока и составляет менее 5% (Laje G. et al., 2012), что может также различаться у представителей разных этнических групп.
В ряде работ было установлено, что наличие у носителей аллеля Met гена мозгового нейротофического фактора BDNF связано с меньшей активацией коры головного мозга и мозжечка (Agartz, 2006), а также с такими проблемами, как нарушения памяти (Egan et al., 2003), аномальная морфология полей гиппокампа и зубчатой извилины (Aas et al., 2014), с повышенной восприимчивостью к таким заболеваниям, как болезнь Альцгеймера (Ji et al., 2015) и депрессия, причем формирование де- прессивных симптомов в ответ на стресс модулируется эпистатическим эффектом генов мозгового нейротрофического фактора (BDNF) в сочетании с геном транспортера серотонина (Калуев, 2006).
Относительно устойчивости носителей полиморфизма Val66Met к действию стресса получены и противоположные данные, например, о том, что при стрессе, вызванном неизлечимой тяжелой болезнью члена семьи, наибольший риск развития депрессивных симптомов наблюдается у лиц с диплотипом BDNF Val/Val в сочетании с геном транспортера серотонина 5-HTTLPR ss (Алфимова и др., 2009). Важную роль играют такие факторы, как этническая принадлежность и пол обследованных лиц, а также соответствие распределения частоты встречаемости аллелей закону Харди-Вайнберга (Алфимова и др., 2009). В то же время, получены данные о том, что проявления депрессии, например, связаны не только с генетической составляющей BDNF Val66Met, но и находятся в сочетанных взаимоотношениях с полом и временем, прошедшим после воздействия психотравмирующих факторов (Fan и др., 2017).
Ген рецептора серотонина HTR2A расположен в 13ql4—q21 области тринадцатой хромосомы, имеет 2 интрона и 3 экзона, является основным возбудительным G-белок- сопряженным рецептором серотонина, однако способен оказывать и ингибирующее воздействие в таких областях, как зрительная и орбитофронтальная кора. Рецепторы серотонина, кодируемые геном 5HTR2A, в существенном количестве содержатся в гиппокампе и передней коре головного мозга, т.е. в структурах, тесно связанных с эмоциональными процессами. В гене 5HTR2A описан полиморфизм 1438A/G, расположенный в области промотора, что обуславливает изменение функциональной активности рецептора в зависимости от наличия аллелей A или G.
В последние годы ген рецептора серотонина 5-HTR2A часто рассматривается в качестве гена-кандидата при изучении психических заболеваний, например, таких как обсессивно-компульсивное расстройство (Walitza et al., 2012), депрессия (Lebe et al., 2013) и шизофрения (Sujitha et al., 2014).
Исследование особенностей вызванной активности мозга у здоровых носителей разных генотипов по гену мозгового нейротрофического фактора и гену рецептора серотонина HTR2A при предъявлении им изображений эмоциогенного характера позволит прогнозировать интенсивность и содержание эмоциональных реакций в зависимости от генотипа. Как известно, вызванные потенциалы имеют ранние, средние и поздние компоненты (Коваленко, Павленко, 2009; Olofsson et al., 2008). Первые отражают реакцию на физические параметры стимулов и не будут анализироваться нами в дальнейшем. Наибольший интерес для психофизиологии представляют средние компоненты, отражающие особенности привлечения внимания и эмоционального реагирования (т. е. эмоциональных процессов, возникающих в ответ на предъявление стимула), а также средние компоненты, связанные с когнитивной оценкой стимулов, процессами категоризации и сличения с имеющимися в памяти образами (Olofsson et al., 2008). В более ранних работах нами были описаны особенности вызванной активности мозга молодых мужчин и женщин, носителей различных генотипов генов моноаминергиче- ской системы MAOA и COMT. Было получено, что наличие мутантных аллелей исследуемых генов ассоциировано со специфическими особенностями оценки эмоционально окрашенных и нейтральных изображений, в связи с чем было принято решение продолжить поиск возможных генетических предикторов успешности/неуспешности различения эмоциональной валентности стимулов и определения их потенциальной угрозы (Ермаков и др., 2016; Ковш, 2016; Vorobyeva et al., 2016). В данной работе зрительная модальность предъявляемых стимулов была выбрана в качестве изучаемой в виду того, что зрительная система является ведущим каналом приема экстерорецептивной информации и выявление закономерностей функционирования, лежащих в основе распознавания, категоризации образов и эмоциональных ответов, имеет особенное значение для более глубокого понимания закономерностей обработки разного рода информации человеком.
Цель работы — исследование особенностей вызванной активности мозга, связанной с анализом эмоциогенных изображений, у носителей различных генотипов генов BDNF и HTR2A.
Гипотеза: могут быть выявлены особенности вызванной электрической активности мозга при анализе изображений эмоциогенного характера у лиц со сниженной (генотип Val/Met гена мозгового нейротофического фактора BDNF) и высокой (генотип Val/Val гена мозгового нейротрофического фактора BDNF) кортикальной пластичностью, а также у лиц с разными генотипами по гену рецептора серотонина HTR2A.
Методика исследования
В исследовании участвовали 40 человек, 20 юношей и 20 девушек в возрасте 19— 22 лет, проживающие в г. Ростове-на-Дону. Все участники сдали образцы тканей в виде буккального эпителия для генетического анализа.
Выделение ДНК из клеток буккального эпителия проводилось методом полимеразной цепной реакции (ООО «БиРеТ», г. Москва, Россия). Забор буккального эпителия проводился после двух часов сухого голода. В ходе генетического анализа были проанализированы следующие участки ДНК:
— Ген нейротрофического фактора мозга BDNF (последовательность по ГенБанку NG_011794, мутация 68690G>A Val66Met, rs-код rs6265). Возможные генотипы: Val/Val, Val/Met, Met/Met. В анализируемой выборке соотношение генотипов следующее: Val/ Val — 26 человек, Val/Met — 14 человек, Met/Met — 0.
— Ген рецептора серотонина HTR2A (последовательность по ГенБанку, NG_013011, мутация 4692G>A, rs6311 (Tr2). Возможные генотипы: G/G, G/A, A/A. В анализируемой выборке соотношение генотипов следующее: A/A — 12 человек, A/G — 14 человек, G/G — 14 человек. Рецептор серотонина HTR2A (последовательность по ГенБанку, NG_013011, кодон- синоним Ser34; мутация 6230С>Т, rs6313 (Tr3). Возможные генотипы: T/T, T/C, C/C. В анализируемой выборке соотношение генотипов следующее: T/T — 12 человек, T/C — 14 человек, C/C — 14 человек. Генетический анализ показал, что носители доминантных (GG), гетерозиготных (GA) и минорных (AA) генотипов полиморфизма Tr2 гена рецептора серотонина второго типа имеют аналогичные генотипы по полиморфизму Tr3 (TT, TC, CC соответственно). В дальнейшем мы будем использовать обозначение генотипов по полиморфизму Tr2 (A/G), подразумевая наличие у носителя аналогичного генотипа по полиморфизму Tr3.
Для регистрации электроэнцефалограммы и вызванных потенциалов (ВП) мозга использовался многоканальный электроэнцефалограф Нейровизор-136 (производства компании «МКС», Россия). Запись проводилась монополярно по схеме «5—5» в 128 отведениях с двумя ушными референтами (А1, А2), с максимальным подэлектродным сопротивлением до 40 кОм. Частота дискретизации сигнала составляла 1000 Гц.
В ходе эксперимента испытуемые должны были просмотреть последовательность стимульных изображений эмоциогенного характера, и оценить их с точки зрения того, какое эмоциональное отношение они вызывают, нажав на соответствующую клавишу клавиатуры: «1» — не нравится (отрицательный ответ), «2» — нейтрально (нейтральный ответ), «3» — нравится (положительный ответ). База данных изображений, использованная в данном исследовании, состоит из стимулов, отнесенных методом экспертных оценок к группам «позитивные», «нейтральные», «негативные» (всего 573 изображения; в среднем, по 180—200 стимулов в каждой группе); база данных была разработана и применялась нами в предыдущих исследованиях (Ермаков и др., 2016; Ковш, 2016; Vorobyeva et al., 2016). Такое распределение стимулов обеспечило возможность сравнения параметров вызванной активности мозга участников исследования при оценке эмоционально окрашенных и нейтральных изображений. Физические параметры стимулов (размер, яркость, контраст) были уравнены. Средняя яркость стимульного изображения соответствовала яркости фона и составила 22.5 кд. Угловые размеры: 9 угловых градусов по ширине и 12 — по высоте. Размер изображения — 1024*768 пикселей. Стимулы располагались на однородном сером фоне, который оставался на экране монитора и после их исчезновения. Каждое изображение в ходе эксперимента предъявлялось однократно в течение 500 мс, оценки испытуемыми предъявляемых изображений фиксировались. Межстимульный интервал варьировал от 1 до 2 секунд в целях предотвращения развития эффекта ожидания. Следующее изображение появлялось на экране только после того, как испытуемый оценивал предыдущее и завершался межстимульный интервал. Испытуемым давалась дополнительная инструкция с просьбой постараться избежать моргания в момент выбора ответа на стимул.
Обработка полученных вызванных потенциалов включала в себя нарезку записей на эпохи, удаление эпох с артефактами немозгового происхождения, усреднение полученных ВП по целевым группам и статистический анализ. Все указанные этапы были выполнены в вычислительной среде Matlab 14.09 с помощью пакета функций EEGLAB, предназначенного для обработки ЭЭГ, вызванной активности и МЭГ (Delorme et al., 2004). При усреднении проводилась коррекция базового уровня ВП путем вычитания предстимульного интервала. Анализ вызванной активности проводился с применением непарного t-критерия Стьюдента (по каждому измерению) с поправкой Холма на множественность сравнений, отдельно для групп с генотипами BDNF Val/Val — Val/Met, и групп с генотипами HTR2A A/A, A/G и G/G при выборе негативного, нейтрального или позитивного ответа на стимульные изображения. Вызванная активность анализировались с точки зрения латентных, амплитудных характеристик и пространственного распределения потенциалов по коре мозга. Эпоха анализа ВП составила 500 мс от момента нажатия на клавишу. Уровень значимости различий составлял p≤0,05.
Результаты исследования
BDNF. Ниже приведены результаты попарного анализа вызванных потенциалов для трех видов ответов (положительный, нейтральный, отрицательный) на предъявляемые изображения для групп испытуемых с генотипами Val/Val и Val/Met.
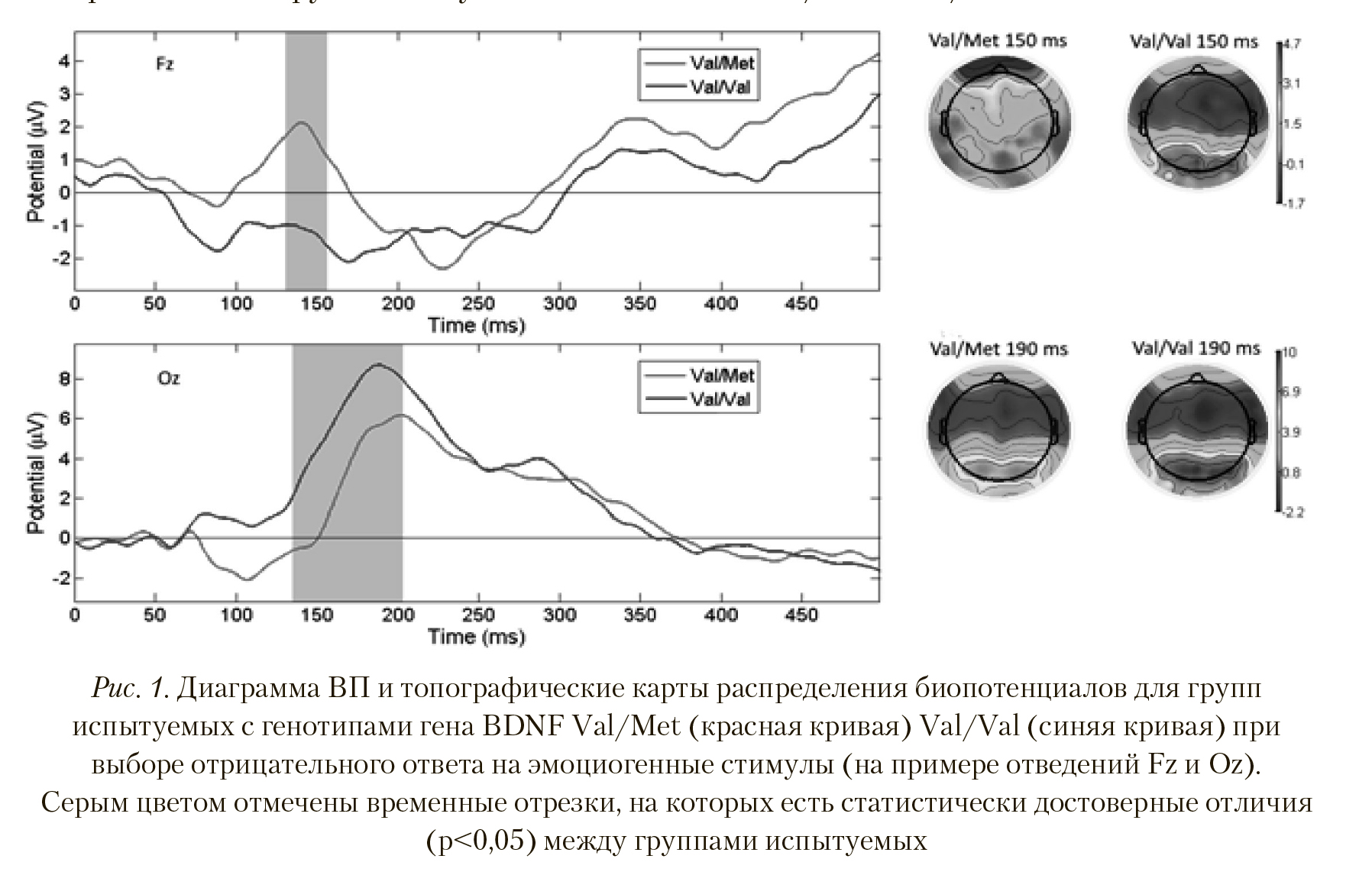
На Рисунке 1 видно, что амплитуда и скорость формирования пика латентностью 140—160 мс у испытуемых с полиморфизмом Val/Met достоверно больше (р < 0,038; T = 1,1), чем у Val/Val (вверху). Достоверные отличия также наблюдались по отведениям Af3, Af4, Aff5h, Aff6h, Aff1h, Aff2h, F1, Fz, F2, F4, F5, F6, F8, F10, Ftt10h, Ffc10h, Ffc1h, Ffc2h, Ffc6h, Ftt8h, Fc3, Fc1, Fcz, Fc2, Fc4, Fc6, Ft8, Fcc4h, Fcc6h, Ftt8h, Ftt10h, T8. На топографической карте распределения биопотенциалов видны пространственные различия в генерации ВП. При выборе участниками исследования отрицательного ответа на предъявляемые стимулы у испытуемых с полиморфизмом Val/Met наблюдалась большая активация передних и передне-центральных областей. У группы с полиморфизмом Val/Val выбор отрицательного ответа на предъявляемые стимулы вызывал активацию теменно-затылочных зон с большей амплитудой пика ВП латентностью 150-200 мс в отведениях P1, Ppo1h, Ppo2h, P6, Po7, Po3, Poz, Po4, Po8, Ppo10h, P10, O1, Oz, O2, Poo1, Poo2, Po8, Po9, Poo10h, Po10, Oi1h, Oi2h, I1,I2 (p < 0,004; T = -3,101).
Анализ ВП при выборе испытуемыми нейтрального ответа на эмоциогенные стимулы показал иную картину вызванной активности головного мозга. На Рисунке 2 отчетливо видна разница амплитуд (p < 0,027; T = -2,331) в пике ВП в сегменте 200 мс между группами испытуемых с полиморфизмами Val/Val и Val/Met. Сходные отличия наблюдались по отведениям P1, Pz, P6, Ppo5h, Ppo1h, Ppo2h, Ppo6h, Ppo9h, Po7, Po3, Poz, Poo9h, O1, Oz, Oi2h.
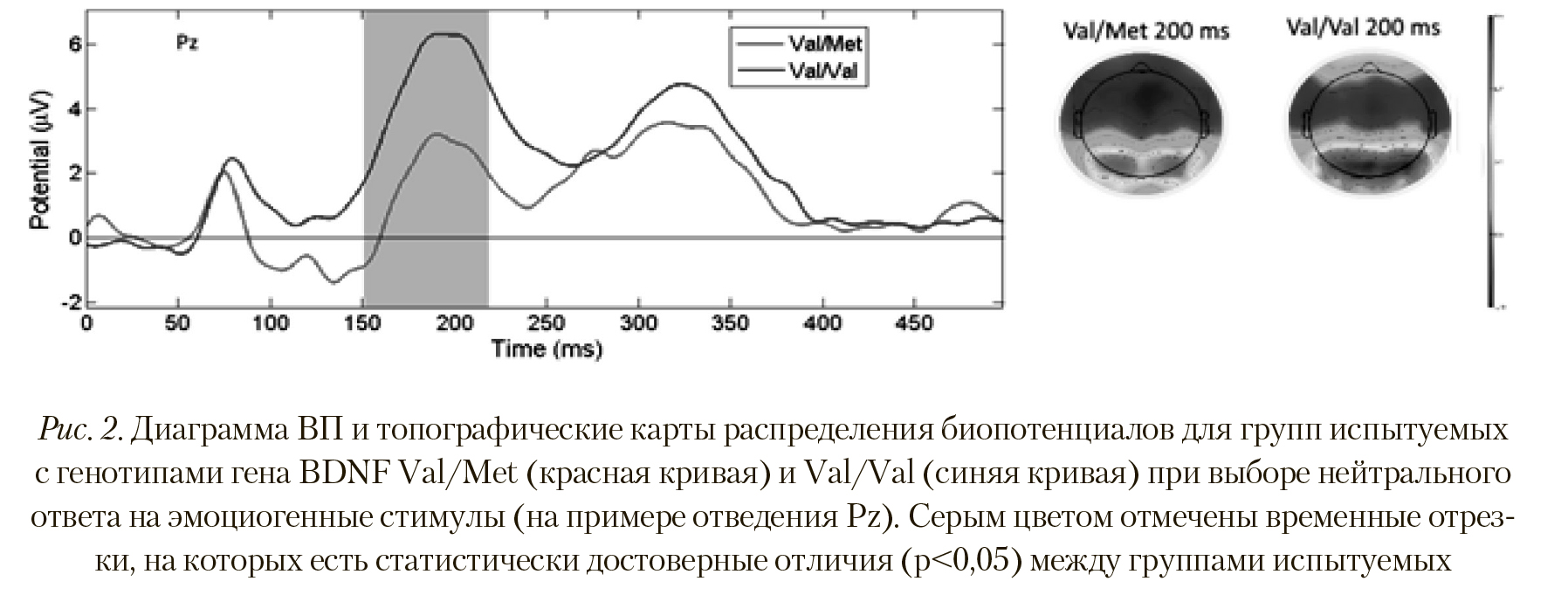
Топографическая карта распределения вызванной электрической активности также указывает на большую активацию затылочных областей при выборе ней трального ответа у испытуемых группы Val/Val (Рисунок 2). Этот факт может служить свидетельством более интенсивной работы вовлеченных областей коры у данной группы при выборе нейтрального ответа.
При выборе положительного ответа на предъявляемый стимул картина изменения вызванной активности во многом аналогична той реакции, которая сопровождала выбор негативного ответа.
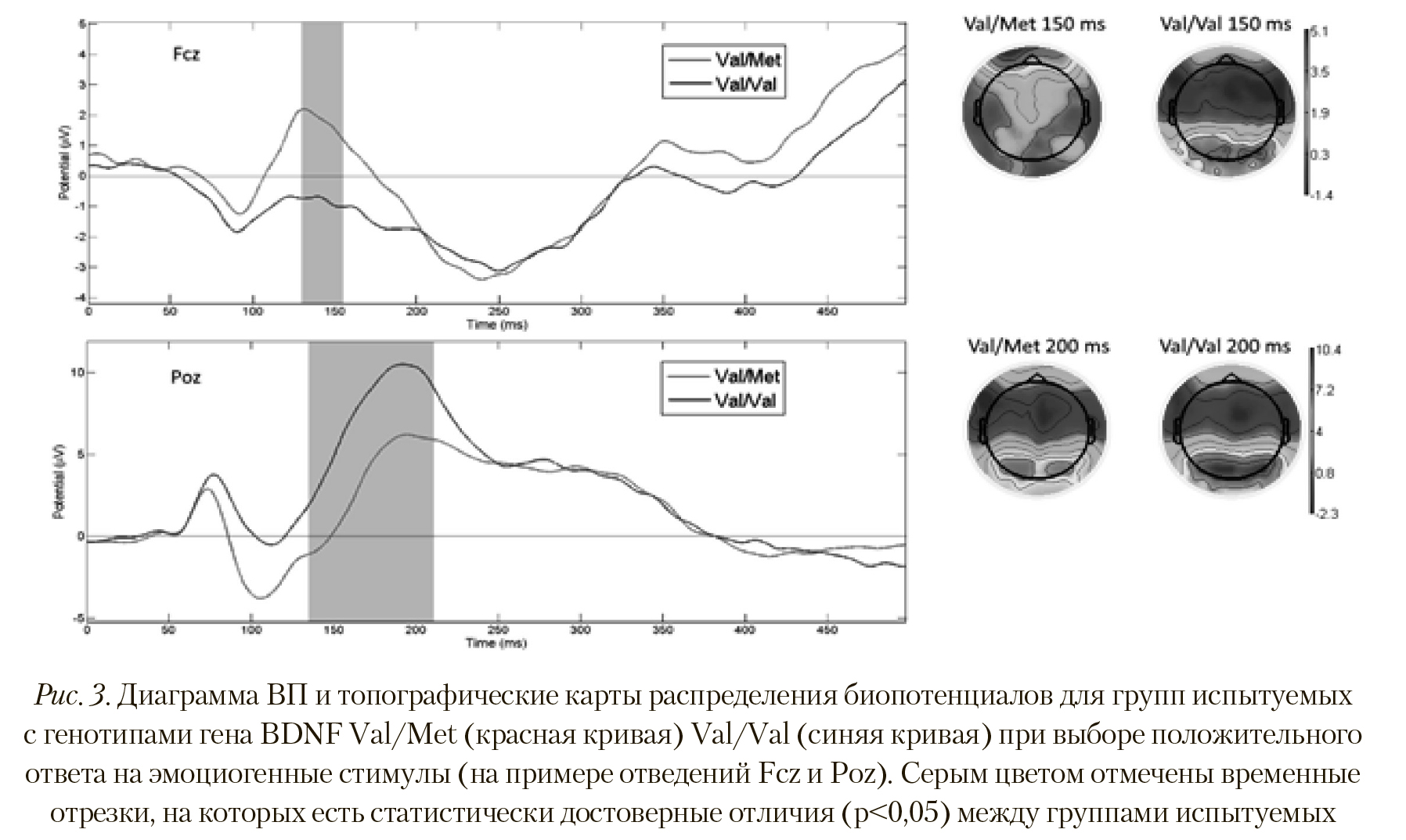
На Рисунке 3 видно, что у испытуемых из группы Val/Met при выборе положительного ответа на ВП сформирован пик в сегменте латентностью 150—200 мс, имеющий достоверно большую амплитуду, чем у группы Val/Val (p < 0,008; T = 2,337) в отведениях Af3, Af8, Aff6h, Fp1, F10, F8, F6, F4, F1, F3, F7, Fc1, Fc2, Fcz, Fc4, Fc6, Ft8. Этот факт говорит о более интенсивной активности заинтересованных областей мозга при выборе такого типа ответов. И наоборот — у группы Val/Val амплитуда ВП в сегменте 140-200 мс достоверно больше в отведениях P1, Pz, P6, P8, P9, Ppo5h, Ppo1h, Ppo2h, Ppo6h, Ppo9h, Po7, Foz, Ppo10h, P10, Po9, Poo9h, O1, Oz, O2, Poo1, Po10, oi1h, I1, чем у Val/Met (p < 0,012; T = -2,743).
Пространственное распределение активности также отличается. На Рисунке 3 видно, что у группы Val/Met при выборе 11().,1()Ж1ггс.л->11ого ответа передние и i^ентржтьные области более активны, в то время как у группы Val/Val активность выше в теменно-затылочных областях коры.
HTR2A. Ниже представлены результаты анализа ВП при делении экспериментальной выборки на группы по генотипам гена рецептора серотонина HTR2A.
По итогам обработки полученных данных показано, что вызванная активность при выборе отрицательного ответа на предъявляемые стимулы у групп испытуемых, разделенных по генотипам гена рецептора серотонина HTR2А A/A, A/G, и G/G, достоверно отличается как по амплитудам компонентов ВП, так и по пространственному распределению вызванных ответов.
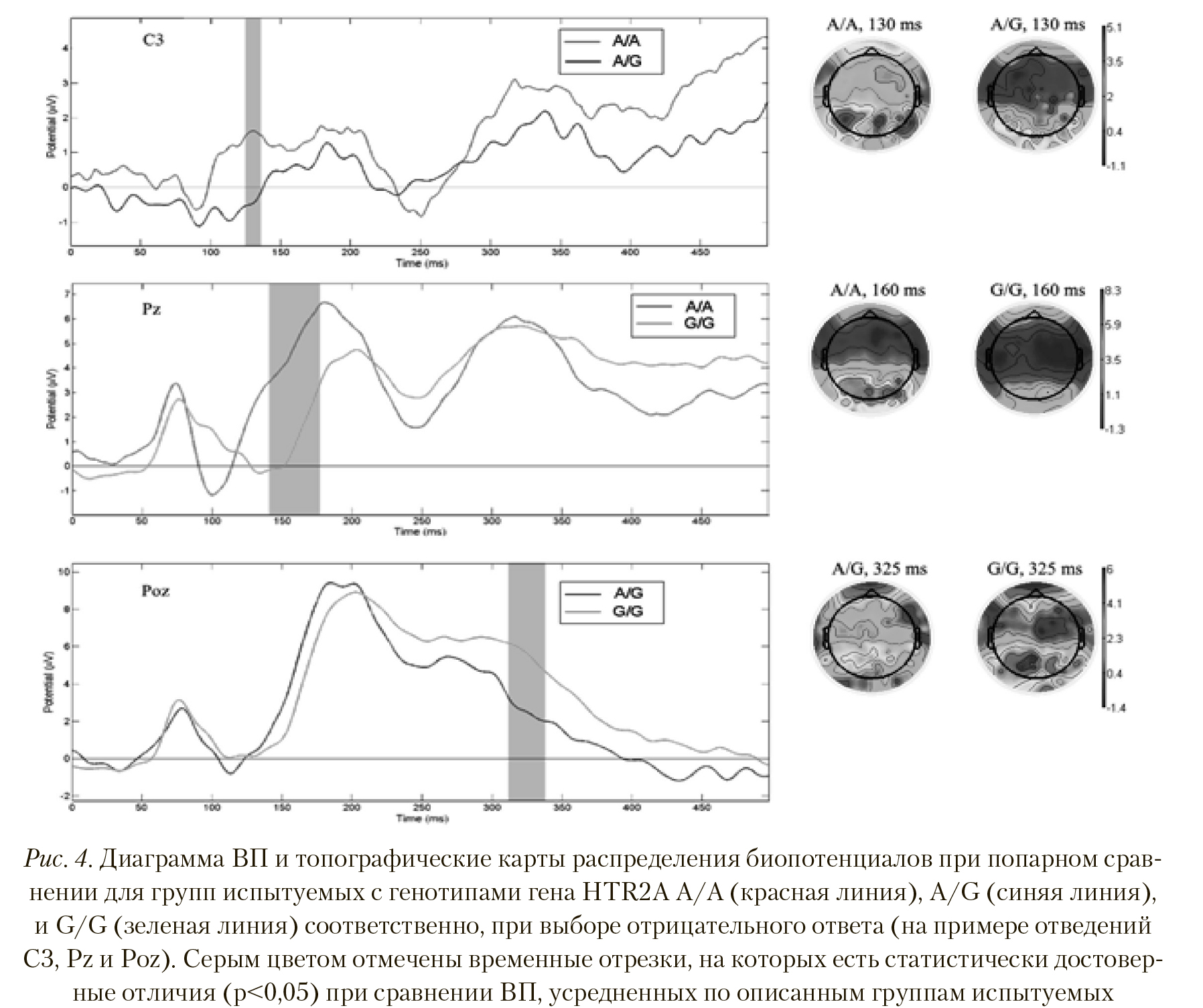
На Рисунке 4 (верхний) видно, что при выборе отрицательного ответа у группы с генотипом A/A амплитуда ВП латентностью 130—140 мс достоверно больше в отведениях T7, C3, C5, C1, Ccp1h, Ftt7h, Fttt9h, Ft7, Fft7h, F5, Fft8h, Fft10h, Ftt10h, Ttp10h, P5 (p < 0,023, T = 2,493), чем у группы с генотипом A/G. Также на Рисунке 4 видно, что у группы с генотипом A/A вызванный ответ интенсивен почти по всей коре мозга и особенно в центральных и задневисочных отделах обоих полушарий, в отличие от группы с генотипом A/G, для которой выбор отрицательного ответа не вызвал такой масштабной активации областей коры.
Сравнение ВП у групп испытуемых с генотипами A/A и G/G показало достоверные различия по отведениям Cp5, Cp3, Cp1, Cpz, Cp2, Cp4, Cp6, Ccp5h, Cpp3h, Cpp1h, Cpp2h, Cpp4h, Cpp6h, Tp8, Tpp7h, Tpp8h, Tpp10h, P5, P3, P1, Pz, P4, P6, P9, Ppo5h, Ppo1h, Ppo9h, Po7, Poz, Po8, Ppo10, Po9, Poo9h, O1, Oz, O2, Po10, Oi2h, Poo10, I1, I2 во временном сегменте латентностью 140—175 мс (p < 0,007, T = 3,01), причем амплитуда потенциалов больше у группы с генотипом A/A. Пространственные различия отчетливо видны на топографической карте (Рисунок 4, центральная иллюстрация) — у испытуемых группы с генотипом A/A выбор отрицательного ответа вызывает значительно большую активацию центральных, теменных и затылочных областей коры.
Парное сравнение полученных для групп с генотипами A/G и G/G вызванных потенциалов продемонстрировало значимые отличия в латентности поздних компонентов ВП в районе 320—340 мс в отведениях Tp9, Tpp7h, Tpp9h, P5, P3, P1, Poz, P2, P9, Ppo5h, Ppo1h, Ppo9h, Po7, Po3, Po9, Poo1h, Poo9h, Poo10h, Poo1, Poo2, O1, Oz, I1, I2, Oi2h (p < 0,031, T = -2,315). Амплитуда данного пика ВП у группы испытуемых с генотипом G/G достоверно больше, чем у группы испытуемых с генотипом A/G. На Рисунке 4 (нижняя иллюстрация) отчетливо видна большая активность теменных и затылочных отделов у группы с генотипом G/G, чем у группы с генотипом A/G при выборе отрицательного ответа на предъявляемые эмоциогенные стимулы.
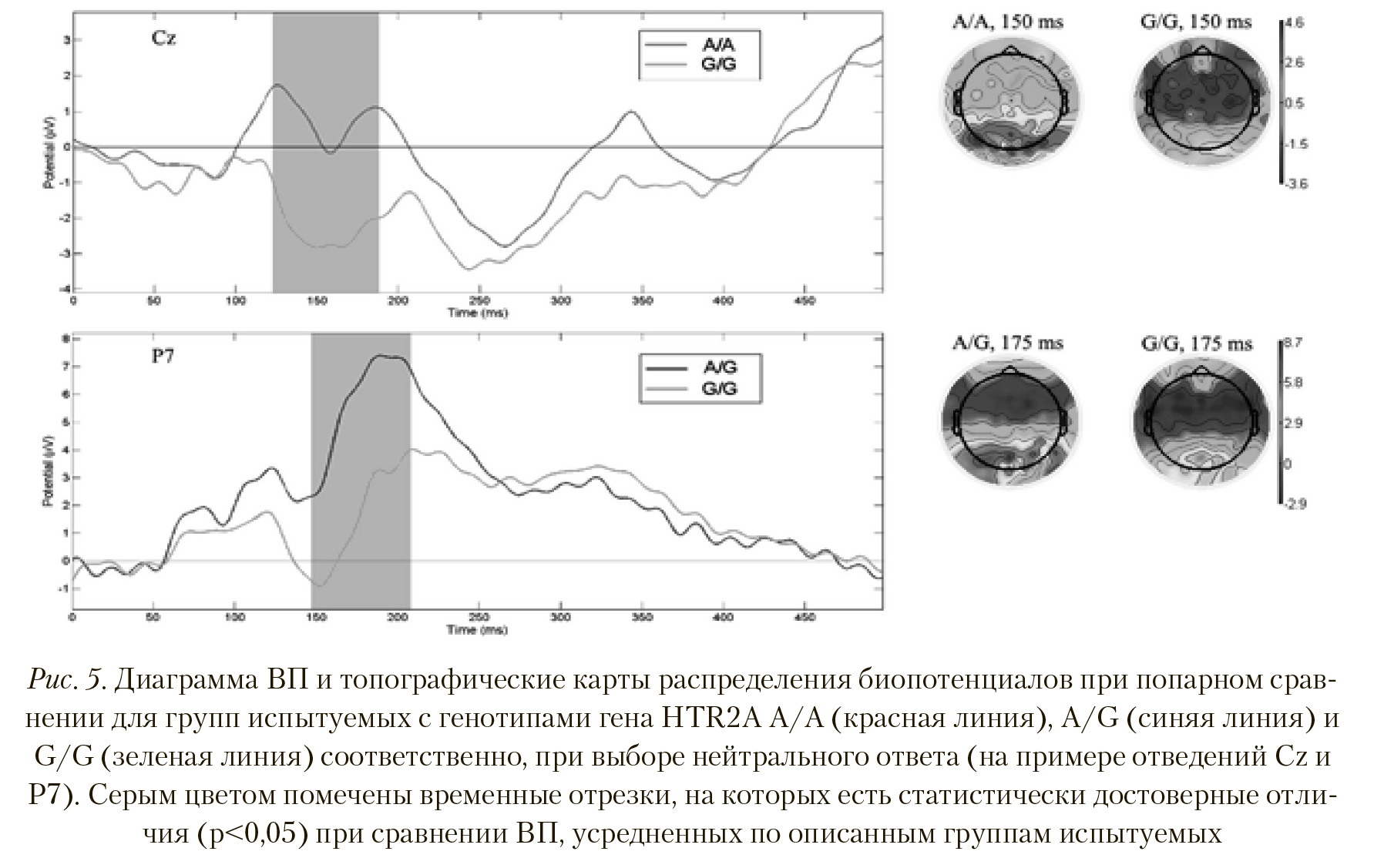
В отличие от ВП, полученных для отрицательного ответа на стимульные изображения, при сравнении данных, полученных для нейтрального ответа у групп с генотипами HTR2А A/A и A/G, не было найдено статистически достоверных отличий в вызванный активности мозга. Попарное сравнение групп с генотипами A/A — G/G и A/G — G/G показало, что картина вызванного ответа для этих групп имеет значимые отличия, подробный анализ которых приведен ниже. На верхней иллюстрации Рисунка 5 показаны временные и пространственные различия в ВП при сравнении вызванных ответов групп с генотипами HTR2A A/A и G/G. Испытуемые группы А/А продемонстрировали значительно большую амплитуду пика ВП латентностью 125-170 мс, по сравнению с группой G/G (p < 0,006, T = 3,054), в отведениях T7, C5, C3, C1, Cz, C2, C4, C6, Ttp7h, Ccp5h, Ccp3h, Ccp1h, Ccp2h, Ccp4h, Ccp6h, Tp8, Tp10, Tpp7h, Cpp5h, Cpp3h, Ccp1h, Cpp2h, Cpp4h, Cpp6h, Tpp9h, P7, P5, P3, P1, P4, P8, P9, P10, Po7, O1. Пространственные различия также существенны — при выборе нейтрального ответа у группы А/А наблюдается значительно выраженная активность не только в теменно-затылочных областях, но и, более умеренная, в других отделах коры, в отличие от группы G/G.
Касательно полученных результатов для групп A/G и G/G, на Рисунке 5 (нижняя иллюстрация) представлены достоверные отличия в ВП латентностью 150-200 мс по отведениям Tp7, Tp8, Tp9, Tpp7h, Tpp8h, Tpp9h, Tpp10h, Cp5, Cp3, Cp4, Cp6, Cpp5h, Cpp3h, Cpp4h, Ccp6h, P7, P5, P3, P1, P6, P8, P9, Ppo2h, Ppo5h, Ppo6h, Ppo10h, Po7, Po4, Po0, Po9, P10, Poo9h, O1, I1 (p < 0,002, T = 3,456), причем амплитуда вызванного ответа у группы A/G значительно больше. Этот факт находит свое отражение в пространственной картине распределения амплитуд ВП — у испытуемых группы с генотипом A/G в затылочных областях активность выше, чем у группы с генотипом G/G.
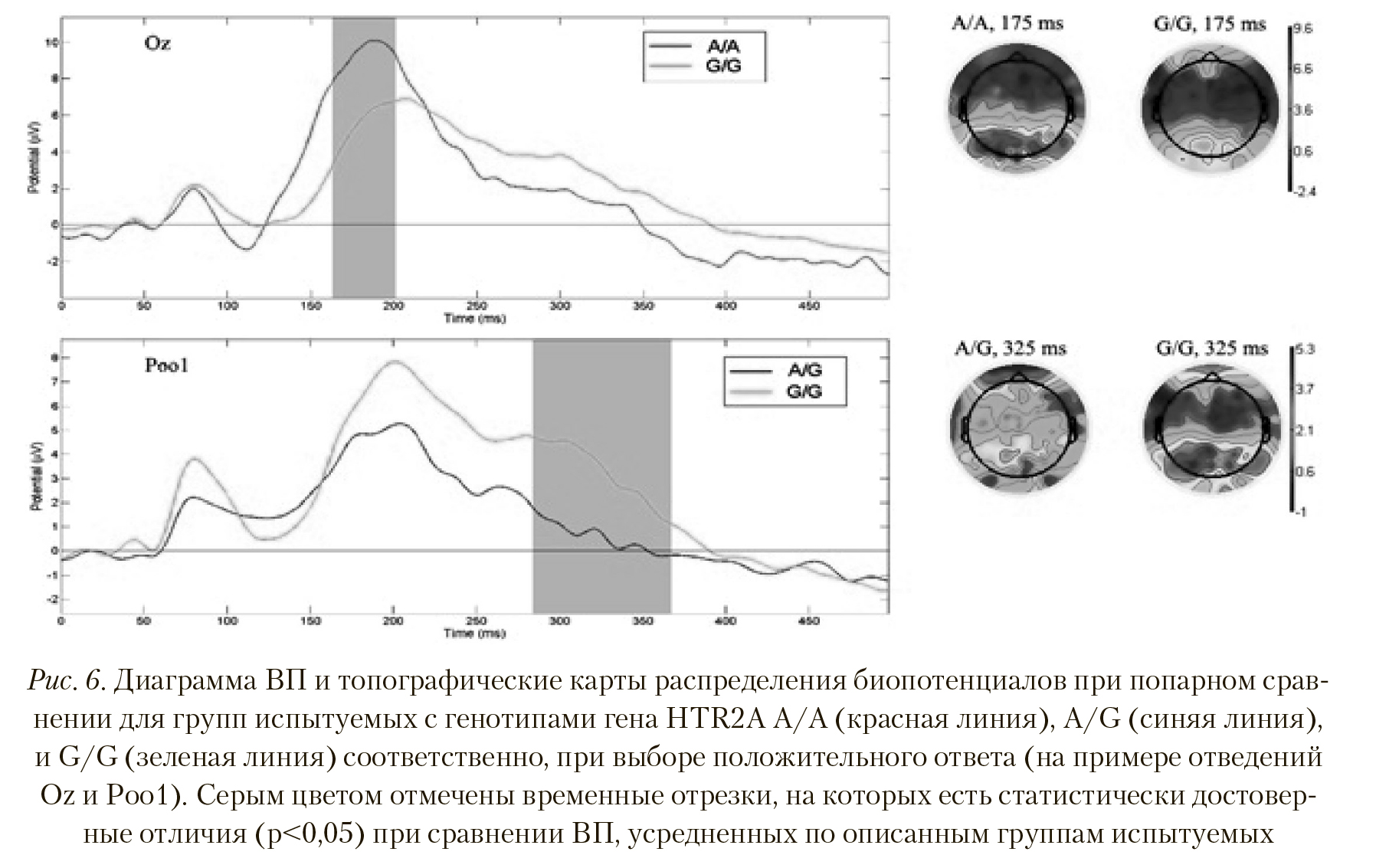
Так же, как и в случае с выбором нейтрального ответа, ВП групп с генотипами HTR2A A/A и A/G, полученные для положительных ответов на стимулы, достоверно не различались. Сравнение ВП для групп A/A и G/G показало достоверные различия в районе 160— 200 мс по отведениям Cp5, Cp3, Cp4, Cp6, Tpp7h, Cpp4h, Cpp6h, Tpp8h, Tp8, P7, P5, P3, P1, P4, P8, P9, P10, Po7, Poz, Ppo9h, Ppo10h, O1, Oz, O2 (p < 0,01, T = 4,485), при этом амплитуда данного пика больше у испытуемых группы A/A (Рисунок 6).
Пространственные различия также имеют место — активность затылочных и теменных областей у группы с генотипом A/A выше, чем у группы с генотипом G/G. Картина активности при сравнении ВП у групп с генотипами A/G и G/G при выборе положительного ответа напоминает таковую при выборе негативного варианта. На Рисунке 6 отчетливо видны отличия между ВП групп A/G и G/G латентностью 290—350 мс (p < 0,005, T = -3,11), причем амплитуда волны ВП испытуемых группы с генотипом G/G больше. Наряду с отведением Ppo1, сходные отличия наблюдаются в отведениях P5, P8, Po7, Po3, Po4, Po8, Po9, Poz, Tpp10h, Ppo9h, Ppo10h, Ppo2h, Ppo6h, Poo2, Poo9h, O1, Oz, I1. Пространственные различия сосредоточены в теменно-затылочных областях — их активность также выше у испытуемых группы с генотипом G/G.
Обсуждение
По гену мозгового нейротрофического фактора BDNF нами получены данные о том, что отрицательная или положительная эмоциональная оценка стимула связана с большей активацией передне-центральных областей коры у лиц с гетерозиготным генотипом Val/Met в сравнении с гомозиготами Val/Val. Ввиду того, что статистическая достоверность различий в амплитуде пика выражена в районе 150 мс (средний компонент ВП), это может быть интерпретировано как свидетельство более выраженной эмоциональной реакции на стимул у лиц с гетерозиготным генотипом Val/Met. При этом у испытуемых с гомозиготным генотипом Val/Val большая активация теменно-затылочных зон коры (со статистически достоверно большей амплитудой пика на 190 мс вызванной активности) может рассматриваться как свидетельство более тщательной оценки нюансов и составляющих зрительного образа по сравнению с обладателями гетерозиготного генотипа Val/Met. Таким образом, лица со сниженной кортикальной пластичностью (генотип Val/Met) демонстрируют более высокую эмоциональность, а лица с высокой кортикальной пластичностью (генотип Val/Val) — более тщательную обработку деталей зрительного образа.
Сведения о влиянии генотипов гена мозгового нейротрофического фактора (BDNF Val66Met) и гена-переносчика серотонина (5-HTTLPR) на выполнение различного рода когнитивных задач получены, в основном, в клинических исследованиях. Так, в работе Голимбет и др., 2016 г. было установлено, что у здоровых в отношении психических болезней носителей генотипа Val / Val (BDNF Val66Met) мозгового нейротрофического фактора имеется преимущество в эффективности распознавания слов, по сравнению с носителями аллеля Met. Та же закономерность была обнаружена и в отношении носителей генотипа SS гена-переносчика серотонина (5-HTTLPR), по сравнению с носителями аллеля L. Для выборки больных шизофренией данные закономерности не были обнаружены. Мета-обзор исследований (Notaras et al., 2015) связи полиморфизма Val66Met гена BDNF и шизофрении показал, что полиморфизм Val66Met проявляется плейотропно посредством целого ряда признаков, включая возраст начала, симптоматику, тяжесть протекания заболевания, восприимчивость к лекарственной терапии, когнитивные процессы и морфологию мозга. Получены доказательства того, что аллель 66Met ассоциируется с депрессией (Verhagen et al., 2010). Расстройства пищевого поведения, такие как анорексия и булимия, также связаны с аллелем 66Met (Mercader et al., 2010). Носители аллеля Met подвергаются более высокому риску развития посттравматического стрессового расстройства, а также проявляют более выраженные симптомы ПТСР, чем гомозиготы Val / Val (Dai et al., 2017).
Неоднозначные влияния генотипов Val66Met на поведение человека в стрессовой ситуации, а также риск развития психических заболеваний могут найти объяснение в рамках имеющихся знаний о «copy number variations» (вариации числа копий, CNVs) — присутствии в геноме человека значительных по длине (от нескольких тысяч до нескольких миллионов пар нуклеотидов) участков, которые могут встраиваться в ген, образуя две копии (дупликация) или выпадать из структуры гена (делеция), при этом CNVs мутации могут не только наследоваться, но и возникать de novo (Голимбет, 2016).
C полиморфизмом Val66Met связана способность к зрительно — пространственной ориентации у больных с заболеваниями шизофренического спектра, так, было установлено, что способности к зрительно-пространственной ориентации были нарушены у носителей аллеля 66Met (по сравнению с гомозиготами по аллелю 66Val), что сопровождалось уменьшением серого вещества в височной и затылочной областях. При этом в группе здоровых лиц указанные различия в зрительно-пространственных способностях и в морфологии коры между носителями полиморфизма Val66Met не наблюдались (Ho et al., 2006; Notaras et al., 2015).
Исследования фоновой ЭЭГ показали общее увеличение медленноволновой активности (в диапазоне тета и дельта) и снижение быстрой волновой активности (альфа) у носителей аллеля Met гена BDNF, что указывает на увеличение тормозной и уменьшение возбудительной синаптической активности в коре головного мозга (Gatt et al., 2008).
Исследования событийно-связанных потенциалов мозга показали, что носители аллеля Met имеют худшие электрофизиологические показатели внимания, по сравнению с носителями Val, что проявляется в увеличении латентного периода и в уменьшении амплитуды компонента Р300 (Schofield, 2009; Getzmann, 2013), в то же время в другой работе не было выявлено специфических различий в фоновой ЭЭГ и в параметрах P300 у носителей аллеля Met (Soltész et al., 2014).
С использованием слуховых событийно-связанных потенциалов (ERP) получены данные о влиянии полиморфизма BDNF Val66Met на когнитивные процессы, составляющие цикл отвлечения внимания, ориентации и переориентации внимания. При этом установлено, что в условиях отвлечения внимания с помощью слуховых дистракторов, эффективность носителей генотипа Val/Val меньше, чем у носителей гетерозиготного генотипа Val/Met (Getzmann et al., 2013).
В работе Barton et al., 2014, выполненной в университете Калифорнии с привлечением 35 гомозиготных Val/Val и 40 гетерозиготных Val/Met носителей аллелей гена BDNF, при решении задач, требующих зрительно-моторной адаптации, ожидалось, что гомозиготные носители Val/Val, обладающие более высокой нейронной пластичностью, справятся с предлагаемыми задачами за более короткое время. Однако были получены противоположные результаты, и статистически достоверное более короткое время решения задач показали гетерозиготные носители.
Проведенное нами исследование, а также анализ литературных данных, приведенных выше, позволяют сделать предварительное заключение о том, что здоровые носители разных аллелей гена мозгового нейротрофического фактора BDNF имеют различающиеся особенности вызванной активности мозга при анализе изображений эмоциогенного характера. Обладатели доминантного гомозиготного генотипа Val/Val (обеспечивающего высокую кортикальную пластичность) характеризуются более тщательной обработкой деталей зрительного образа, при этом лица с гетерозиготным генотипом Val/Met обнаруживают более высокую эмоциональность (возможно, в некоторой степени препятствующую обработке деталей зрительного образа).
По гену рецептора серотонина HTR2A нами получены данные о том, что у лиц с доминантным гомозиготным генотипом G/G (в сравнении с гетерозиготами A/G) отрицательная или положительная эмоциональная оценка стимула связана с большей активацией теменно-затылочных областей коры. Ввиду того, что статистически достоверно большая амплитуда пика зарегистрирована на 325 мс вызванной активности (поздний, когнитивный компонент), это может быть интерпретировано как тщательная оценка нюансов и составляющих зрительного образа.
У лиц с рецессивным гомозиготным генотипом А/А отрицательная эмоциональная оценка стимула связана с масштабной активацией коры головного мозга, наиболее выраженной в центральных и задневисочных отделах обоих полушарий. Ввиду того, что статистическая достоверность различий в амплитуде пика выражена в районе 130 мс (средний компонент ВП), это может расцениваться как проявление выраженной эмоциональной реакции с вовлечением избыточных мозговых ресурсов. При этом положительная эмоциональная оценка стимула у носителей данного генотипа связана с активацией коры затылочных и теменных областей, что проявляется в увеличении амплитуды компонента P175 и может быть интерпретировано как проявление оценки деталей зрительного образа.
В работе В.Е. Голимбет, проводившей исследование полиморфного маркера А-1438G, показано, что носители гетерозиготного генотипа HTR2A АG обладают пониженным уровнем социальной интроверсии и тревожности (Голимбет и др., 2004). Позже было установлено, что наличие в генотипе аллеля G увеличивает риск формирования депрессии средней и тяжелой степени в 2,4 раза по сравнению с группой носителей генотипа АА (Голимбет и др., 2013). Установлено, что полиморфизм A1438G гена HTR2A может быть ассоциирован с самонаправленным агрессивным (суицидальным) и импульсивным поведением (Зайнуллина и др., 2016). Показана ассоциация наличия A-аллеля гена HTR2A с показателями враждебности у мужчин африканского племени датога: носители гетерозиготного генотипа характеризуются самым высоким средним баллом враждебности по сравнению с носителями других генотипов (Суходольская, 2016).
На основании проведенного нами исследования (которое в настоящее время продолжается), а также данных, полученных в работах других авторов, можно сделать предварительное заключение о том, что здоровые носители разных аллелей гена рецептора серотонина HTR2A в ходе анализа изображений эмоциогенного характера демонстрируют различающиеся особенности вызванной активности мозга, указывающие на наличие более высокоадаптивных механизмов у доминантных гомозигот (с генотипом G/G) по сравнению с гетерозиготами (A/G) и, в особенности, рецессивными гомозиготами (A/А).
Выводы
Подтвердилась выдвинутая в нашей работе гипотеза о наличии особенностей вызванной электрической активности мозга при анализе изображений эмоциогенного характера у лиц со сниженной (генотип Val/Met гена мозгового нейротофического фактора BDNF) и высокой (генотип Val/Val гена мозгового нейротрофического фактора BDNF) кортикальной пластичностью, а также у лиц с разными генотипами по гену рецептора серотонина HTR2A.
1. Выявлены особенности вызванной электрической активности мозга при анализе изображений эмоциогенного характера у лиц со сниженной (генотип Val/Met гена мозгового нейротофического фактора BDNF) и высокой кортикальной пластичностью (генотип Val/Val гена мозгового нейротрофического фактора BDNF). Эмоциональная оценка стимула во время регистрации вызванной электрической активности мозга связана с большей активацией передне-центральных областей коры (со статистически достоверно большей амплитудой пика на 150 мс вызванной активности) у лиц с гетерозиготным генотипом Val/ Met гена мозгового нейротрофического фактора BDNF, что может быть интерпретировано как свидетельство более выраженной эмоциональной реакции на стимул. Более тщательная обработка деталей зрительного образа, которая проявляется как большая активация теменно-затылочных зон (со статистически достоверно большей амплитудой пика на 190 мс вызванной активности), свойственна для испытуемых с гомозиготным генотипом Val/Val.
2. Описаны особенности вызванной электрической активности мозга при анализе изображений эмоциогенного характера у лиц с разными генотипами по гену рецептора серотонина HTR2A. Получено, что у лиц с доминантным гомозиготным генотипом G/G отрицательнм или положительная эмоциональная оценка стимула связана с большей активацией теменно-затылочных областей (со статистически достоверно большей амплитудой пика на 325 мс вызванной активности, по сравнению с лицами с гетерозиготным генотипом A/G), что может быть ассоциировано с оценкой нюансов и составляющих зрительного образа при анализе стимула. У лиц с рецессивным гомозиготным генотипом А/А отрицательная эм со u-ioiia/ioii ая оценка стимула связана с масштабной активацией коры головного мозга, наиболее выраженной в центральных и задневисочных отделах. При этом положительная эмоцыoí iалоная оценка стимула у них связана с активацией коры затылочных и теменных областей (со статистически достоверно большей амплитудой пика на 130 мс вызванной активности), что может рассматриваться как проявление оценки деталей зрительного образа. Таким образом, оценивание зрительного стимула как отрицательного у лиц с рецессивным гомозиготным генотипом А/А требует привлечения значительно больших мозговых ресурсов, по сравнению с носителями доминантного аллеля G.
Перспективы дальнейшего исследования
По мере увеличения объема выборки и накопления молекулярно-генетических и психофизиологических данных перспективными направлениями развития данной исследовательской работы видятся следующие: анализ гендерных различий внутри выборки при формировании ответной реакции на эмоциогенные стимулы, с учетом распределения генотипов у мужчин и женщин; сравнение ВП, полученных при выборе ответов на стимульные изображения, с ВП, записанными при восприятии эмоциогенных изображений в момент их непосредственного предъявления; исследование мозговых источников генерации ВП при выборе ответа на эмоционально окрашенные стимулы у лиц с различными генотипами при помощи анализа независимых компонент ВП.
Финансирование
Работа выполнена при поддержке гранта Министерства образования и науки РФ№ 25.3336.2017/ПЧ.
Литература
- Алфимова М.В., Голимбет В.Е., Бархатова А.Н., Голубев С.А., Коровайцева Г.И. Роль генотип-средовых взаимодействийв развитии симптомов тревоги и депрессии при стрессе, связанном с болезнью члена семьи // Журнал неврологии и психиатрии. № 12. 2009. С. 50—54.
- Алфимова М.В., Голимбет В.Е. Гены и нейрофизиологические показатели когнитивных процессов: обзор исследований // Журнал высшей нервной деятельности им. И.П. Павлова. 2011. Т. 61. № 4. С. 389—401.
- Алфимова М.В., Голимбет В.Е., Лебедева И.С., Коровайцева Г.И., Лежейко Т.В. Влияние тревожности и гена COMT на вызванные потенциалы мозга и продуктивность избирательного внимания // Журнал высшей нервной деятельности им. И. П. Павлова. 2014. Т. 64. № 3. С. 270. doi:10.7868/ s0044467714030034.
- Голимбет В.Е. Моногенная модель шизофрении: смена парадигм // Журнал неврологии и психиатрии. № 2. 2016. С. 4—8. doi: 10.17116/jnevro2016116214-8.
- Голимбет В.Е., Алфимова М.В., Митюшина Н.Г. Полиморфные варианты гена рецептора серотонина (5 HTR2A) и особенности личности // Молекулярная биология. 2004. Т. 83. № 3. С. 404—412.
- Голимбет В.Е., Волель Б.А., Должиков А.В., Коровайцева Г.И., Исаева М.И. Ассоциация полиморфизмов генов рецепторов серотонина 5-HTR2A и 5-HTR2C с риском развития депрессии у пациентов с ишемической болезнью сердца // Бюллетень экспериментальной биологии и медицины. 2013. Т. 156. № 11. С. 628—631.
- Голимбет В.Е., Гарах Ж.В., Коровайцева Г.И., Лежейко Т.В., Зайцева Ю.С., Гурович И.Я., Шмуклер А.Б., Родионов Г.И., Стрелец В.Б. Связь генов нейротрофического мозгового фактора и переносчика серотонина с параметрами ранних компонентов вызванных потенциалов при пассивном восприятии слов // Журнал высшей нервной деятельности им. И.П. Павлова. 2016. Т. 66. № 5. С. 556—564.
- Ермаков П.Н., Ковш Е.М., Воробьева Е.В. Особенности вызванной активности мозга девушек- носительниц различных генотипов по маркеру MAOA u-VNTR при оценке эмоционально окрашенных сцен // Российский психологический журнал. 2016. Т. 13. № 4. С. 232—253. doi: 10.21702/ rpj.2016.4.14.
- Зайнуллина А.Г., Валиуллина А. Г., Хуснутдинова Э.К. Роль генетических и средовых факторов риска в формировании суицидального поведения в ходе развития // Геномика поведения: детское развитие и образование / Под ред. С.Б. Малых, Ю.В. Ковас, Д.А. Гайсиной. Томск: Издательский Дом Томского государственного университета, 2016. С. 299—331.
- Калуев А.В. BDNF и серотониновыйтранспортер в патогенезе депрессии // Нейронауки. 2006. № 5. 7. С. 31—34.
- Коваленко А.А., Павленко В.Б. Эмоциональная значимость стимула и черты личности: отражение в паттерне вызванных ЭЭГ-потенциалов // Нейрофизиология. 2009. Т. 41. № 4. С. 336—356.
- Ковш Е.М. Психофизиологические и психологические особенности мужчин и женщин, носителей полиморфизмов генов МАОА и СОМТ, с разным уровнем агрессивности. Диссертация кандидата психологических наук. Ростов-на-Дону: Южный федеральный университет, 2016. 286 с.
- Суходольская Е.М. Изучение аллельного полиморфизма генов нейромедиаторных систем, ассоциированных с поведенческими реакциями. Диссертация на соискание ученой степени кандидата биологических наук. Москва: Институт биологии, 2016. 146 с.
- Aas, M., Haukvik, Djurovic, Tesli, Athanasiu, Bjella, T., Hansson, L., Cattaneo, A., Agartz, I., Andreassen, O.A., Melle, I. Interplay between childhood trauma and BDNF val66met variants on blood BDNF mRNA levels and on hippocampus subfields volumes in schizophrenia spectrum and bipolar disorders // Journal of Psychiatric Research. 2014. № 59. pp. 14—21.
- Agartz I., Sedvall G.C., Terenius L., Kulle B., Frigessi A., Hall H., et al. BDNF gene variants and brain morphology in schizophrenia // American Journal of Medical Genetics. 2006. Part B: Neuropsychiatric Genetics. № 141B (5). pp. 513—523.
- Basic Neurochemistry: Principles of Molecular, Cellular and Medical Neurobiology / Еd. Brady S.T. Academic press. 2012. 1096 p.
- Barton B., Treister A., Humphrey M., Abedi G., Cramer S.C., Brewer A.A. Paradoxical visuomotor adaptation to reversed visual input is predicted by BDNF Val66Met polymorphism // J. Vis., 2014. № 14(9). Р. 4. doi: 10.1167/14.9.4 https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4125061/
- Bilder R.M., Volavka J., ál Czobor P., Malhotra A.K., Kennedy J.L., Ni X., Citrome L. Neurocognitive correlates of the COMT Val 158 Met polymorphism in chronic schizophrenia // Biological psychiatry. 2002. Vol. 52. № 7. Р. 701—707.
- Bramon E., Dempster E., Frangou S., McDonald C., Schoenberg P., MacCabe J.H., Walshe M., Sham P., Collier D., Murray R.M. Is there an association between the COMT gene and P300 endophenotypes? // Eur. Psychiatry. 2006. Vol. 21. Р. 70—73.
- Chen Z.Y., Patel P.D., Sant G., Meng C.X., Teng K.K., Hempstead B.L., et al. Variant brain-derived neurotrophic factor (BDNF) (Met66) alters the intracellular trafficking and activity-dependent secretion of wild-type BDNF in neurosecretory cells and cortical neurons // The Journal of Neuroscience. 2004. № 24 (18). Р. 4401—4411.
- Dai, W., Kaminga, A.C., Wu, X., Wen, S.W., Tan, H., Yan, J., Deng, J., Lai, Z., Liu, A. Brain-Derived Neurotropic Factor Val66Met Polymorphism and Posttraumatic Stress Disorder among Survivors of the 1998 Dongting Lake Flood in China // BioMed Research International. 2017. № 4569698. doi: 10.1155/2017/4569698 https://www.scopus.com/record/display.uri?eid=2-s2.0-85019999468&origin=re sultslist&sort=plf-f&src=s&st1=BDNF&nlo=&nlr=&nls=&sid=223b3d07ddd1588de3e5d6aa9da5a785&s ot=b&sdt=sisr&sl=19&s=TITLE-ABS-KEY%28BDNF%29&ref=%28%28PTSD%29%29+AND+%28PT SD+risk%29&relpos=14&citeCnt=0&searchTerm=
- Delorme A., Makeig S. EEGLAB: an open source toolbox for analysis of single-trial EEG dynamics including independent component analysis // Journal of neuroscience methods. 2004. Vol. I. 134. № 1. Р. 9—21. doi: 10.1016/j.jneumeth.2003.10.009.
- Dumontheil I., Roggeman C., Ziermans T., Peyrard-Janvid M., Matsson H., Kere J., Klingberg T. Influence of the COMT genotype on working memory and brain activity changes during development // Biological Psychiatry. 2011. Vol. 70. Р. 222—229.
- Egan M.F., Kojima M., Callicott J.H., Goldberg T.E., Kolachana B.S., Bertolino A., et al. The BDNF val66met polymorphism affects activity-dependent secretion of BDNF and human memory and hippocampal function // Cell. 2003. № 112 (2). Р. 257—269.
- Fan M., Li R.H., Hu M.S., Xiao L.Y., Zhou X.D., Ran M.S., Fang D.Z. Association of Val66Met polymorphism at brain derived neurotrophic factor gene with depression among Chinese adolescents after Wenchuan earthquake: An 18 months longitudinal study // Physiology and Behavior. 2017. № 179. Р. 16—22.
- Ji H., Dai D., Wang Y., Jiang D., Zhou X., Lin P., Ji X., Li J., Zhang Y., Yin H., Chen R., Zhang L., Xu M., Duan S., Wang Q. Association of BDNF and BCHE with Alzheimers disease Meta-analysis based on 56 genetic case-control studies of 12,563 cases and 12,622 controls // Experimental and Therapeutic Medicine. 2015. Vol. 9. № 5. Р. 1831—1840.
- Gatt J.M., Kuan S.A., Dobson-Stone C., Paul R.H., Joffe R.T. et al. Association between BDNF Val66Met polymorphism and trait depression is mediated via resting EEG alpha band activity // Biol Psychol. 2008. № 79(2). Р. 275—284.
- Getzmann S., Gajewski P.D., Hengstler J.G., Falkenstein M., Beste C. BDNF Val66Met polymorphism and goal-directed behavior in healthy elderly — evidence from auditory distraction // NeuroImage. 2013. № 64. Р. 290—298. https://doi.org/10.1016/j.neuroimage.2012.08.079.
- Ho B.C., Milev P., O’Leary D.S., Librant A., Andreasen N.C., Wassink T.H. Cognitive and magnetic resonance imaging brain morphometric correlates of brain-derived neurotrophic factor Val66Met gene polymorphism in patients with schizophrenia and healthy volunteers // Arch. Gen. Psychiatry. 2006. № 63 (7). Р. 731—740.
- Laje G., Lally N., Mathews D., Brutsche N., Chemerinski A., et al. Brain-derived neurotrophic factor Val66Met polymorphism and antidepressant efficacy of ketamine in depressed patients // Biol Psychiatry. 2012. № 72(11). Р. 27—28.
- Lebe M., Hasenbring M., Schmieder K. et al. Association of serotonin-1A and -2A receptor promoter polymorphisms with depressive symptoms, functional recovery, and pain in patients 6 months after lumbar disc surgery // Pain. 2013. № 154(3). Р. 377—384.
- Mercader J.M., Fernández-Aranda F., Gratacòs M., Aguera Z.a, Forcano L.a, Ribasés M.df, Villarejo C., Estivill X. Correlation of BDNF blood levels with interoceptive awareness and maturity fears in anorexia and bulimia nervosa patients // Journal of Neural Transmission. 2010. Vol. 117. № I. 4. Р. 505—512.
- Bilder R.M., Volavka J., ál Czobor P., Malhotra A.K., Kennedy J.L., Ni X., Citrome L. Neurocognitive correlates of the COMT Val 158 Met polymorphism in chronic schizophrenia // Biological psychiatry. 2002. Vol. 52. № 7. Р. 701—707.
- Bramon E., Dempster E., Frangou S., McDonald C., Schoenberg P., MacCabe J.H., Walshe M., Sham P., Collier D., Murray R.M. Is there an association between the COMT gene and P300 endophenotypes? // Eur. Psychiatry. 2006. Vol. 21. Р. 70—73.
- Chen Z.Y., Patel P.D., Sant G., Meng C.X., Teng K.K., Hempstead B.L., et al. Variant brain-derived neurotrophic factor (BDNF) (Met66) alters the intracellular trafficking and activity-dependent secretion of wild-type BDNF in neurosecretory cells and cortical neurons // The Journal of Neuroscience. 2004. № 24 (18). Р. 4401—4411.
- Dai, W., Kaminga, A.C., Wu, X., Wen, S.W., Tan, H., Yan, J., Deng, J., Lai, Z., Liu, A. Brain-Derived Neurotropic Factor Val66Met Polymorphism and Posttraumatic Stress Disorder among Survivors of the 1998 Dongting Lake Flood in China // BioMed Research International. 2017. № 4569698. doi: 10.1155/2017/4569698 https://www.scopus.com/record/display.uri?eid=2-s2.0-85019999468&origin=re sultslist&sort=plf-f&src=s&st1=BDNF&nlo=&nlr=&nls=&sid=223b3d07ddd1588de3e5d6aa9da5a785&s ot=b&sdt=sisr&sl=19&s=TITLE-ABS-KEY%28BDNF%29&ref=%28%28PTSD%29%29+AND+%28PT SD+risk%29&relpos=14&citeCnt=0&searchTerm=
- Delorme A., Makeig S. EEGLAB: an open source toolbox for analysis of single-trial EEG dynamics including independent component analysis // Journal of neuroscience methods. 2004. Vol. I. 134. № 1. Р. 9—21. doi: 10.1016/j.jneumeth.2003.10.009.
- Dumontheil I., Roggeman C., Ziermans T., Peyrard-Janvid M., Matsson H., Kere J., Klingberg T. Influence of the COMT genotype on working memory and brain activity changes during development // Biological Psychiatry. 2011. Vol. 70. Р. 222—229.
- Egan M.F., Kojima M., Callicott J.H., Goldberg T.E., Kolachana B.S., Bertolino A., et al. The BDNF val66met polymorphism affects activity-dependent secretion of BDNF and human memory and hippocampal function // Cell. 2003. № 112 (2). Р. 257—269.
- Fan M., Li R.H., Hu M.S., Xiao L.Y., Zhou X.D., Ran M.S., Fang D.Z. Association of Val66Met polymorphism at brain derived neurotrophic factor gene with depression among Chinese adolescents after Wenchuan earthquake: An 18 months longitudinal study // Physiology and Behavior. 2017. № 179. Р. 16—22.
- Ji H., Dai D., Wang Y., Jiang D., Zhou X., Lin P., Ji X., Li J., Zhang Y., Yin H., Chen R., Zhang L., Xu M., Duan S., Wang Q. Association of BDNF and BCHE with Alzheimers disease Meta-analysis based on 56 genetic case-control studies of 12,563 cases and 12,622 controls // Experimental and Therapeutic Medicine. 2015. Vol. 9. № 5. Р. 1831—1840.
- Gatt J.M., Kuan S.A., Dobson-Stone C., Paul R.H., Joffe R.T. et al. Association between BDNF Val66Met polymorphism and trait depression is mediated via resting EEG alpha band activity // Biol Psychol. 2008. № 79(2). Р. 275—284.
- Getzmann S., Gajewski P.D., Hengstler J.G., Falkenstein M., Beste C. BDNF Val66Met polymorphism and goal-directed behavior in healthy elderly — evidence from auditory distraction // NeuroImage. 2013. № 64. Р. 290—298. https://doi.org/10.1016/j.neuroimage.2012.08.079.
- Ho B.C., Milev P., O’Leary D.S., Librant A., Andreasen N.C., Wassink T.H. Cognitive and magnetic resonance imaging brain morphometric correlates of brain-derived neurotrophic factor Val66Met gene polymorphism in patients with schizophrenia and healthy volunteers // Arch. Gen. Psychiatry. 2006. № 63 (7). Р. 731—740.
- Laje G., Lally N., Mathews D., Brutsche N., Chemerinski A., et al. Brain-derived neurotrophic factor Val66Met polymorphism and antidepressant efficacy of ketamine in depressed patients // Biol Psychiatry. 2012. № 72(11). Р. 27—28.
- Lebe M., Hasenbring M., Schmieder K. et al. Association of serotonin-1A and -2A receptor promoter polymorphisms with depressive symptoms, functional recovery, and pain in patients 6 months after lumbar disc surgery // Pain. 2013. № 154(3). Р. 377—384.
- Mercader J.M., Fernández-Aranda F., Gratacòs M., Aguera Z.a, Forcano L.a, Ribasés M.df, Villarejo C., Estivill X. Correlation of BDNF blood levels with interoceptive awareness and maturity fears in anorexia and bulimia nervosa patients // Journal of Neural Transmission. 2010. Vol. 117. № I. 4. Р. 505—512.
Информация об авторах
Метрики
Просмотров web
За все время: 2187
В прошлом месяце: 21
В текущем месяце: 14
Скачиваний PDF
За все время: 957
В прошлом месяце: 5
В текущем месяце: 2
Всего
За все время: 3144
В прошлом месяце: 26
В текущем месяце: 16